Qué es la pseudouridina, por qué te la inyectan y por qué debería importarte. El pionero en el desarrollo de las ideas y la reducción a la práctica del uso de ARNm sintético como método de “terapia génica” transitoria, Dr. Robert W Malone, explica algunas de las diferencias entre lo que se previó originalmente y las moléculas actuales que se están inyectando en nuestros cuerpos.
La versión original de este artículo en inglés y con enlaces puede consultarse en The Epoch Times.
Por el Dr. Robert W Malone
El pasado mes de enero, Stew Peters decidió desplegar la tesis de que tengo responsabilidad personal por la morbilidad y la mortalidad asociadas a las vacunas de ARNm COVID-19, como consecuencia de mi trabajo pionero en el desarrollo de las ideas y la reducción a la práctica del uso de ARNm sintético como método de “terapia génica” transitoria, siendo la aplicación de entrada para fines de vacunación. Muchos detractores enfadados en las redes sociales han buscado a alguien a quien culpar de las mentiras y los acontecimientos adversos que se han asociado a estas vacunas de ARNm. Teniendo en cuenta esas críticas, este ensayo de Substack se centra en algunas de las diferencias entre lo que se previó originalmente y las moléculas actuales que se están inyectando en nuestros cuerpos. La primera sección del ensayo establece el escenario resumiendo (para un lector general) cómo se desarrolló toda la idea de la terapia génica, y luego describiendo cómo y por qué esto llevó a la idea del ARNm como medicamento y como método para generar una respuesta a la vacuna. La segunda sección es bastante técnica y ofrece información detallada destinada a un público científico. La conclusión está escrita para un público general.
“Si el resplandor de mil soles estallara a la vez en el cielo, sería como el esplendor del poderoso”. “Ahora me he convertido en la Muerte, el destructor de mundos”. – J. Robert Oppenheimer, director científico del Proyecto Manhattan (citando el Bhagavad Gita).
###Terapia génica, transhumanismo y los orígenes del ARNm como medicamento o vacuna
La idea central plasmada en las nueve patentes originales que surgen de mi trabajo entre 1987 y 1989 era que existen múltiples problemas clave con la idea de la “terapia génica” permanente, tal y como la concibieron originalmente el doctor Richard Roblin y el pediatra académico Dr. Theodore Friedman en 1972. La encarnación moderna de este concepto se puede encontrar en los muchos escritos de la FEM y otros en relación con el “transhumanismo” y el uso de la tecnología de edición de genes CRISPR/Cas9. Para entender realmente todo esto se requiere un breve viaje a través de la historia y la lógica de la “terapia génica”.
El artículo del centro de noticias de la UC San Diego de enero de 2015 titulado “Friedman reconocido por su investigación pionera en terapia génica: School of Medicine professor receives prestigious Japan Prize” resume muy bien la lógica subyacente de la “terapia génica” tal y como la conciben Friedman y Roblin.
“Aunque se planteaba como una pregunta, Friedmann y Roblin creían firmemente que la respuesta era afirmativa, citando el pensamiento emergente, los nuevos estudios y los crecientes datos que sugerían que el “ADN bueno” podía utilizarse para sustituir el ADN defectuoso en personas con afecciones hereditarias.
“En nuestra opinión”, escribieron, “la terapia génica puede mejorar algunas enfermedades genéticas humanas en el futuro. Por esta razón, creemos que la investigación dirigida al desarrollo de técnicas para la terapia génica debe continuar.”
Aunque Friedmann dijo que la respuesta inicial al artículo “no fue abrumadora”, ahora se cita comúnmente como un hito importante en los inicios científicos de la investigación en terapia génica, aunque Friedmann dijo que fue la conferencia de Asilomar tres años después (los científicos establecieron normas de seguridad para la tecnología del ADN recombinante) donde realmente “explotó el interés”.
La idea de la terapia génica, que rápidamente captó la imaginación del público, se vio alimentada por su atractivo enfoque directo y por lo que Friedmann ha descrito como “corrección obvia”: Desarmar un virus potencialmente patógeno para hacerlo benigno. Rellenar estas partículas virales con ADN normal. A continuación, se inyectan en pacientes portadores de genes anormales, donde entregarán sus cargas terapéuticas dentro de las células objetivo defectuosas. En teoría, el ADN bueno sustituye o corrige la función anormal de los genes defectuosos, haciendo que las células previamente dañadas sean completas, normales y sanas. Fin de la enfermedad”.
Bonita teoría, ¿qué podría salir mal? El artículo continúa…
“En 1968, Friedmann, trabajando en los Institutos Nacionales de la Salud en Bethesda, Maryland, con el difunto Jay Seegmiller (miembro fundador de la Facultad de Medicina) y otros, demostró que añadiendo ADN extraño a células cultivadas de pacientes con el síndrome de Lesch-Nyhan, podían corregir los defectos genéticos que causaban el raro pero devastador trastorno neurológico. La enfermedad fue descrita por primera vez por el Dr. William Nyhan, profesor de pediatría de la UC San Diego, y el estudiante de medicina Michael Lesch en 1964.
La hazaña constituyó una poderosa prueba de concepto, pero los esfuerzos posteriores por llevar el trabajo a ensayos clínicos en humanos se estancaron. “Empezamos a darnos cuenta de que sería muy complicado llevar esta idea y hacerla funcionar en las personas”, dijo Friedmann, que se incorporó a la facultad de Medicina en 1969.
En 1990, una niña de 4 años con una enfermedad congénita llamada deficiencia de adenosida deaminasa (ADA), que afecta gravemente a la inmunidad y a la capacidad de combatir infecciones, se convirtió en la primera paciente tratada mediante terapia génica. Se le extrajeron glóbulos blancos, se les insertó el gen normal de la ADA mediante un virus modificado y desactivado, y se volvieron a inyectar las células. A pesar de las afirmaciones iniciales de éxito, Friedmann dijo que el experimento se consideró finalmente un fracaso. La enfermedad de la niña no se curó y la investigación se consideró insuficiente.
Un informe encargado por el director de los Institutos Nacionales de la Salud, el doctor Harold Varmus, fue muy crítico con todo el campo de la terapia génica y con el esfuerzo de la ADA en particular, reprendiendo a los investigadores por crear una “percepción errónea y generalizada de éxito”. Friedmann dice que se tomó el informe de Varmus “como algo personal. Me sentí muy mal. Casi me hizo sentir que me había estado engañando a mí mismo y a mis colegas durante más de dos décadas sobre la promesa de la terapia génica.” Pero también sabía que había “mucha más gente buena investigando en terapia génica que pícaros” y continuó con diligencia y conciencia su propia investigación.
No obstante, la atención de los medios de comunicación y el bombo y platillo sobre la terapia génica siguieron siendo desenfrenados, alimentados en parte por las opiniones demasiado entusiastas de algunos científicos. La situación se vino abajo en 1999 cuando un paciente de 18 años llamado Jesse Gelsinger, que padecía una enfermedad genética del hígado, murió durante un ensayo clínico en la Universidad de Pensilvania. La muerte de Gelsinger fue la primera atribuida directamente a la terapia génica. Las investigaciones posteriores revelaron numerosos problemas en el diseño experimental”.
La historia del informe Varmus ofrece un primer vistazo al funcionamiento de los NIH y del HHS de Estados Unidos. El científico designado para dirigir la comisión de revisión de la ciencia de la “terapia génica” no era otro que mi mentor de posgrado, el Dr. Inder Verma, que había sido durante mucho tiempo uno de los principales defensores de la terapia génica, y que posteriormente se vio obligado a dimitir del Instituto Salk por un historial de décadas de lo que más suavemente podría llamarse faltas éticas. Pero éste era el científico nombrado por el director general de los NIH para investigar “independientemente” el rigor científico y los méritos del campo. Una mano lava la otra.
¿Qué es lo que falla en el concepto original de “terapia génica”? Hay múltiples problemas, y aquí hay algunos:
1) ¿Se puede introducir eficazmente el material genético (“polinucleótidos”) en el núcleo de la mayoría de las células del cuerpo humano para poder realizar cualquier defecto genético (o mejora genética transhumana)? En resumen, no. Las células humanas (y el sistema inmunitario) han desarrollado muchísimos mecanismos para resistir la modificación por polinucleótidos externos. De lo contrario, ya estaríamos invadidos por diversas formas de ADN y ARN parasitarios, tanto virales como de otro tipo. Esto sigue siendo una barrera técnica importante, que los “transhumanistas” siguen pasando por alto en su entusiasta pero ingenua carrera por jugar a ser dioses con la especie humana. ¿Qué son los polinucleótidos? Básicamente, los polímeros de cadena larga compuestos por cuatro bases nucleotídicas (ATGC en el caso del ADN, AUGC en el caso del ARN) que transportan toda la información genética (que conocemos) a través del tiempo.
2) ¿Y el sistema inmunitario? Bueno, este fue uno de mis descubrimientos a finales de la década de 1980. Lo que Ted (Friedman) imaginó originalmente fue la simple idea de que si un niño tenía un defecto genético de nacimiento que hacía que el cuerpo produjera una proteína defectuosa o no produjera una proteína crítica (como el síndrome de Lesch-Nyhan o la deficiencia de adenosina deaminasa), esto podría corregirse simplemente proporcionando el “gen bueno” para complementar el defecto. Lo que no se apreciaba era que los sistemas inmunitarios de estos niños eran “educados” durante el desarrollo para reconocer la “proteína mala” como normal/propia, o para no reconocer la proteína ausente como normal/propia. Por lo tanto, la introducción del “gen malo” en el cuerpo de una persona provocaría la producción de lo que era esencialmente una “proteína extraña”, lo que provocaría el ataque inmunológico y la muerte de las células que ahora tienen el “gen bueno”.
3) ¿Qué ocurre cuando las cosas van mal y el “gen/proteína bueno” es tóxico? Pues bien, en la situación actual de las vacunas, éste es esencialmente el problema de la “proteína de la espiga”. Me preguntan todo el tiempo “qué puedo hacer para eliminar las vacunas de ARN de mi cuerpo”, a lo que tengo que responder: nada. No hay ninguna tecnología que yo conozca que pueda eliminar estas moléculas sintéticas “similares al ARNm” de su cuerpo. Lo mismo ocurre con cualquiera de los muchos métodos de “terapia génica” que se utilizan actualmente. Sólo tiene que esperar que su sistema inmunológico ataque a las células que han tomado los polinucleótidos y degrade (mastique) la gran molécula ofensiva que hace que sus células fabriquen la proteína tóxica. Dado que prácticamente todos los métodos actuales de “terapia génica” son ineficaces, y esencialmente entregan el material genético al azar a un pequeño subconjunto de células, no hay ninguna forma práctica de eliminar quirúrgicamente las células transgénicas dispersas y relativamente raras. La eliminación de las células modificadas genéticamente por el sistema inmunitario celular (células T) es el único método actualmente viable para eliminar las células que han tomado la información genética extraña (“transfección” en el caso del ARNm o el ADN, o “transducción” en el caso de un gen vectorial viral).
4) ¿Qué ocurre si el “gen bueno” cae en un “mal lugar” de su genoma? Resulta que la estructura de nuestro genoma está muy evolucionada, y todavía somos relativamente neófitos en nuestro nivel actual de comprensión. A pesar de haber secuenciado el genoma humano. El método de “mutagénesis insercional” (pegar información genética en forma de ADN viral o de otras maneras) ha sido durante mucho tiempo uno de los principales métodos para generar nuevos conocimientos sobre genética, desde las moscas de la fruta hasta las ranas, pasando por los peces y los ratones. Cuando se inserta nuevo ADN en los cromosomas, pueden ocurrir muchas cosas inesperadas. Como el desarrollo de cánceres, por ejemplo. Por eso preocupa tanto la posibilidad de que los polinucleótidos similares al ARNm utilizados en las “vacunas de ARN” puedan viajar al núcleo (donde residen los cromosomas de ADN) e insertarse o recombinarse con un genoma celular tras la transcripción inversa (ARN-> ADN). Normalmente, con las tecnologías de terapia génica basadas en el ADN, la FDA exige estudios de genotoxicidad por este motivo, pero la FDA no trató la tecnología de la “vacuna de ARNm” como un producto de terapia génica.
Basándose en estas consideraciones de riesgo, la idea original de utilizar el ARNm como medicamento (con fines terapéuticos genéticos o vacunas) era que el ARNm suele degradarse con bastante rapidez una vez fabricado o liberado en una célula. La estabilidad del ARNm está regulada por una serie de elementos genéticos, entre ellos la longitud de la “cola de poli A”, pero suele oscilar entre ½ y un par de horas. Por lo tanto, si se introduce en el organismo ARNm natural o sintético que se degrada por las enzimas habituales, debería durar muy poco tiempo. Y esta ha sido la respuesta que Pfizer, BioNTech y Moderna han dado a los médicos cuando se les ha preguntado “cuánto dura el ARNm inyectado después de la inyección”.
Pero ahora sabemos que el “ARNm” de las vacunas de Pfizer/BioNTech y Moderna que incorpora el nucleótido sintético pseudouridina puede persistir en los ganglios linfáticos durante al menos 60 días después de la inyección. Esto no es natural y no es realmente ARNm. Estas moléculas tienen elementos genéticos similares a los del ARNm natural, pero son claramente mucho más resistentes a las enzimas que normalmente degradan el ARNm natural, parecen ser capaces de producir altos niveles de proteína durante períodos prolongados y parecen evadir los mecanismos inmunológicos normales para eliminar las células que producen proteínas extrañas que no se observan normalmente en el cuerpo.
Los principales hallazgos de este trabajo seminal de Katharina Röltgen et al. son los siguientes:
En cuanto a la Pseudouridina y el ARNm
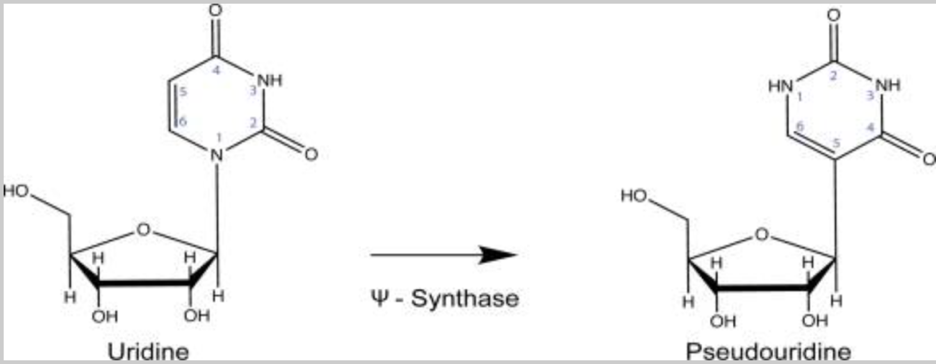
¿Qué es la pseudouridina (símbolo abreviado Ψ)? La pseudouridina es una subunidad de ARNm modificada que prevalece en los ARNm humanos naturales, y la importancia biológica y la regulación del proceso de modificación aún se están determinando y comprendiendo. Esta modificación se produce de forma natural en las células de nuestro cuerpo, de manera altamente regulada. Esto contrasta fuertemente con la incorporación aleatoria de pseudouridina sintética que ocurre con el proceso de fabricación utilizado para producir las vacunas de “ARNm” Moderna y Pfizer/BioNTech (pero no CureVac) COVID-19. El “estado del arte” de la comprensión de la biología de las modificaciones naturales de la pseudouridina se resume a finales de 2020 en esta excelente revisión publicada en la revista Annual Review of Genetics por Erin K Borchardt et al. La versión de código abierto (no protegida por un muro de pago) se puede encontrar aquí. Agárrate, porque estamos a punto de sumergirnos en algo de inmunología, biología molecular y celular.
El resumen es el siguiente:
“Los recientes avances en la detección de pseudouridina revelan un complejo paisaje de pseudouridina que incluye ARN mensajero y diversas clases de ARN no codificante en las células humanas. Las funciones moleculares conocidas de la pseudouridina, que incluyen la estabilización de las conformaciones del ARN y la desestabilización de las interacciones con diversas proteínas de unión al ARN, sugieren que la pseudouridilación del ARN podría tener efectos generalizados en el metabolismo del ARN y la expresión génica. Aquí destacamos lo mucho que queda por aprender sobre las dianas de ARN de las pseudouridilasas humanas, su base para reconocer distintas secuencias de ARN y los mecanismos responsables de la pseudouridilación regulada del ARN. También examinamos las funciones de la pseudouridilación del ARN no codificante en el empalme y la traducción y señalamos los efectos potenciales de la pseudouridilación del ARNm en la producción de proteínas, incluso en el contexto de los ARNm terapéuticos”.
Una publicación más reciente (revisada por expertos) en la revista Molecular Cell ha arrojado luz sobre algunos de los mecanismos de acción asociados a la modificación natural de la pseudouridina. Parece que, en el contexto natural, varias enzimas celulares altamente reguladas (por ejemplo, PUS1, PUS7 y RPUSD4) actúan sobre ARNm específicos y en lugares específicos dentro de esos ARNm mientras se fabrican en la célula para modificar la subunidad normal de nucleótidos de uridina para formar pseudouridina. Estas modificaciones se producen en ubicaciones asociadas a regiones de ARN empalmadas alternativamente, se enriquecen cerca de los sitios de empalme y se solapan con cientos de sitios de unión a proteínas de unión a ARN. Los datos más recientes indican que la pseudouridilación del pre-ARNm es utilizada por las células humanas para regular la expresión de los genes humanos a través del procesamiento alternativo del pre-ARNm.
En relación con las vacunas de “ARNm”, la revisión de Borchardt hace la siguiente declaración sorprendente, que es coherente con el artículo de Cell citado anteriormente, que demuestra que el “ARNm” sintético que se utiliza para estas vacunas persiste en el tejido de los ganglios linfáticos del paciente durante 60 días o más
“Una posibilidad emocionante es que la pseudouridilación regulada del ARNm controle el metabolismo del ARNm en respuesta a las condiciones celulares cambiantes”.
Esa es una forma técnicamente precisa de decir que la incorporación de pseudouridina es un factor que controla el tiempo que un ARNm permanece en el cuerpo.
La revisión continúa con la siguiente declaración alarmante (desde el contexto de la incorporación no regulada de Ψ en las moléculas utilizadas para las vacunas)
“Los efectos biológicos del Ψ deben tener su origen en las diferencias químicas entre U y Ψ, que afectan principalmente a la conformación de la columna vertebral del ARN y a la estabilidad de los pares de bases. Dado que el Ψ puede formar pares estables con G, C y U, además de con A, se ha propuesto como socio de emparejamiento de bases “universal”. A pesar del estudio intensivo de los efectos estructurales del Ψ en oligos de ARN cortos y sintéticos, actualmente es imposible predecir el resultado estructural de la pseudouridilación de ARN en sitios específicos en ARN más largos. La investigación sistemática de los efectos de la secuencia-contexto en la estabilidad de los dúplex que contienen Ψ es un paso importante para realizar predicciones precisas. Será importante determinar las consecuencias estructurales de la pseudouridilación del ARN en las células, lo que es posible utilizando métodos mejorados para sondear la estructura del ARN in vivo”.
Además,
“El efecto de la Ψ en el rendimiento de la proteína funcional depende en gran medida de los codones específicos utilizados. Se desconocen los mecanismos que subyacen a esta dependencia de la secuencia, lo que pone de manifiesto lo mucho que queda por comprender sobre las consecuencias traslacionales de la pseudouridilación del ARNm en las células.”
Por último, en relación con la inmunosupresión que se observa después de múltiples refuerzos de vacunas de ARNm (lo que se denomina cada vez más síndrome de inmunodeficiencia adquirida o enfermedad del SIDA), Borchardt et al enseñan lo siguiente
“Inmunidad innata
Las células están equipadas con sensores inmunitarios innatos, entre los que se encuentran varios receptores tipo Toll (TLR), la proteína inducible por ácido retinoico (RIG-I) y la proteína quinasa R (PKR), que detectan el ácido nucleico extraño. Se ha pensado que las modificaciones del ARN proporcionan un mecanismo para discernir el ARN “propio” del que no lo es y, de hecho, la incorporación de modificaciones del ARN, incluida la pseudouridina, en el ARN extraño permite escapar de la detección inmunitaria innata. Esto hace que la modificación del ARN sea una herramienta poderosa en el campo de la terapéutica del ARN, donde los ARN deben llegar a las células sin desencadenar una respuesta inmunitaria y permanecer estables el tiempo suficiente para lograr los objetivos terapéuticos. Además, la presencia de nucleósidos modificados en el ARN genómico viral podría contribuir a la evasión inmunitaria durante la infección.
Los receptores tipo Toll (TLR) son proteínas asociadas a la membrana que detectan varios patrones moleculares asociados a patógenos (PAMPS) y posteriormente estimulan la producción de citoquinas proinflamatorias. Los TLR sensibles al ARN, TLR3, TLR7 y TLR8, residen en las membranas endosomales. El TLR3 reconoce el dsRNA, mientras que el TLR7 y el TLR8 reconocen el ssRNA. Tras el reconocimiento de la diana, los TLR activan una cascada de señalización que da lugar a la expresión de citoquinas proinflamatorias e interferón. El ARN transcrito in vitro es inmunoestimulante cuando se transfecta en células HEK293 diseñadas para expresar cualquiera de los TLR y la inclusión de Ψ en el ARN suprime esta respuesta (más pronunciada para TLR7 y TLR8).
RIG-I La proteína inducible por ácido retinoico (RIG-I) es un sensor inmunitario innato citosólico responsable de detectar tramos cortos de ARNd o ARNs con un grupo 5′-trifosfato o 5′-disfosfato (una característica común a varios virus de ARN). La activación de RIG-I alivia su autoinhibición, liberando sus dominios CARD para interactuar con MAVS y desencadenar una cascada de señalización que, en última instancia, da lugar a la expresión de factores inmunitarios. La inclusión de Ψ en un ARN con capuchón de 5′-trifosfato suprime la activación de RIG-I, proporcionando otro mecanismo de supresión de la activación inmunitaria innata mediado por la pseudouridina. Además, la región poliU/UC del genoma del VHC también es un potente activador de RIG-I y la sustitución completa de U por Ψ en este ARN anula por completo la inducción de IFN-beta aguas abajo, a pesar de que RIG-I sigue uniéndose al ARN modificado, pero con una afinidad reducida. Durbin et al presentan pruebas bioquímicas de que el RIG-I unido al ARN poliU/UC pseudouridilado no experimenta los cambios conformacionales necesarios para activar la señalización descendente.
La proteína quinasa dependiente de ARN (PKR) es un sensor inmunitario innato residente en el citosol. Al detectar un ARN extraño, la PKR reprime la traducción mediante la fosforilación del factor de iniciación de la traducción eIF-2alfa. Las moléculas que activan la PKR son variadas, pero incluyen el dsRNA formado intra o intermolecularmente, y los grupos 5′ trifosfato. La inclusión de Ψ en varios sustratos de la PKR reduce la activación de la PKR y la represión de la traducción aguas abajo en relación con los ARN no modificados. Por ejemplo, un ARNs corto de 47 nt activa potentemente la PKR cuando se sintetiza con U pero no con Ψ (una reducción de ~30 veces con Ψ). El Ψ también redujo modestamente la actividad de la PKR cuando este ARN corto fue recocido a un ARN 170 complementario no modificado. Asimismo, el ARNt no modificado transcrito in vitro actuó como un activador mucho más potente de la PKR que los ARNt transcritos con pseudouridina. Cabe señalar que no está claro si un ARNt completamente pseudouridilado adopta un plegamiento canónico y qué impacto puede tener esto en el reconocimiento de este sustrato por parte de la PKR. Por último, la transfección de un ARNm no modificado provocó una mayor reducción de la síntesis proteica celular global en el cultivo celular en comparación con el mismo ARNm totalmente pseudouridilado. En consonancia con este resultado, el ARNm totalmente pseudouridilado redujo la activación de la PKR y la posterior fosforilación de eIF-2alfa”.
En cuanto a las consecuencias para el uso del ARNm como fármaco con fines terapéuticos o vacunas, Borchardt et al concluyen que
“La pseudouridina probablemente afecta a múltiples facetas de la función del ARNm, incluyendo la reducción de la estimulación inmunológica por varios mecanismos, la prolongación de la vida media del ARN que contiene pseudouridina, así como los efectos potencialmente deletéreos de la Ψ sobre la fidelidad y la eficiencia de la traducción”.
Conclusión
Sobre la base de esta información, me parece que la amplia incorporación aleatoria de pseudouridina en las moléculas sintéticas similares al ARNm utilizadas para las vacunas contra el SARS-CoV-2 de Pfizer/BioNTech y Moderna bien puede explicar gran parte o la totalidad de la inmunosupresión observada, la reactivación del virus del ADN y la notable persistencia de las moléculas sintéticas de “ARNm” observadas en los tejidos de las biopsias de los ganglios linfáticos por Katharina Röltgen et al. Muchos de estos efectos adversos fueron reportados por Kariko, Weissman et al en su artículo de 2008 “Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability” y podrían haber sido anticipados por los profesionales de la regulación y la toxicología si se hubieran molestado en considerar estos hallazgos antes de permitir la autorización de uso de emergencia y el despliegue generalizado (global) de lo que es realmente una tecnología inmadura y no probada previamente. Por lo tanto, ni la FDA, ni los NIH, ni los CDC, ni BioNTech (que emplea al Dr. Kariko como vicepresidente) ni Moderna pueden alegar verdadera ignorancia. A mis ojos, lo que hemos visto se clasifica más adecuadamente como “ignorancia voluntaria”.
En conclusión, basándome en estos datos, opino que la inserción aleatoria e incontrolada de pseudouridina en las moléculas fabricadas parecidas al “ARNm” que se nos administran a tantos crea una población de polímeros que pueden parecerse al ARNm natural, pero que tienen una serie de propiedades que los distinguen en una variedad de aspectos que son clínicamente relevantes. Estas características y actividades pueden explicar muchos de los efectos inusuales, la estabilidad inusual y los sorprendentes acontecimientos adversos asociados a esta nueva clase de vacunas. Estas moléculas no son ARNm naturales y no se comportan como tales.
La pregunta que más me inquieta y me deja perplejo en este momento es por qué no se investigaron a fondo las consecuencias biológicas de estas modificaciones y los efectos adversos clínicos asociados antes de la administración generalizada de moléculas aleatorias parecidas al “ARNm” que incorporan pseudouridina a una población mundial. La biología, y en particular la biología molecular, es muy compleja y está interrelacionada con la matriz. Si se cambia una cosa aquí, es muy difícil predecir lo que puede ocurrir allí. Por eso hay que hacer investigación no clínica y clínica rigurosamente controlada. Una vez más, me parece que la arrogancia de los científicos de “élite” de alto nivel, los médicos y los burócratas gubernamentales de “salud pública” ha superado el sentido común, se han ignorado normas reguladoras bien establecidas y los pacientes han sufrido innecesariamente como consecuencia.
¿Cuándo aprenderemos?
Desarrollador de la tecnología ARNm explica por qué la vacuna hace el virus más peligroso
Fuente:
Robert W Malone, en The Epoch Times: When Is mRNA Not Really mRNA?